El principio de conservación de la masa para un
volumen e control se puede expresar como la
transferencia neta de masa hacia o desde el volumen durante un intervalo de
tiempo delta t es igual al cambio neto (incremento o disminución) en la masa
dentro del volumen de control durante
delta t.
domingo, 22 de abril de 2012
CALORES ESPECÍFICOS
El calor especifico se defina como la energía
requerida para elevar un grado la temperatura de una unidad de masa de una
sustancia . en termodinámica el interés se centra en dos clases de calores
específicos: calor especifico a volumen contante Cv y calor especifico a
presión constante Cp.
CAMBIO DE FASE
Una transición de una fase a otra es un cambio de
fase. Para una presión dada, los cambios de fase se
dan a una temperatura definida, generalmente acompañada por absorción o emisión
de calor, y un cambio de volumen y densidad El calor requerido por unidad de masa se llama calor
de fusión (o calor latente de fusión), denotado con Lf En
términos más generales, para fundir una masa m de material con calor de
fusión L se requiere una
cantidad de calor Q y puede ser tanto negativa como positiva ya que podemos
revertir el cambio de fase. Usamos el signo más (entra calor) cuando el
material se funde, y el signo menos (sale calor) cuando se
congela. El calor de fusión es diferente para diferentes materiales, y también varía un
poco con la presión. Algo similar sucede con la ebullición o evaporación,
una transición de fase entre líquido y gas. El
calor correspondiente (por unidad de masa) se llama calor de vaporización Lv.
CAPACIDAD CALÓRICA MOLAR
A veces resulta más útil describir una cantidad de
sustancia en términos del número de moles n, en vez de la masa m del material. La masa molar de cualquier sustancia,
denotada con M, es la masa por
mol. El producto de la masa molar M y el calor especifico c nos da como
resultado la capacidad calórica molar denominada C.
CALOR ESPECÍFICO
Usamos el símbolo Q para cantidad de calor. Cuando el calor está asociado a un
cambio de temperatura infinitesimal dT,
lo llamamos dQ. Se observa que la
cantidad de calor Q necesaria para elevar la
temperatura de una masa m de
cierto material de T1 a T2 es aproximadamente
proporcional al cambio de temperatura y a la masa m del material.
CALOR
La
transferencia de energía que se da exclusivamente por una diferencia de
temperatura se denomina flujo de calor o
transferencia de calor, en tanto que la energía transferida se llama calor. El aumento de temperatura es directamente proporcional a la cantidad de trabajo realizado. La unidad en la que se
expresa el calor es la caloría y se
define como la energía necesaria para elevar la temperatura de 1g de agua en 1ºc.
TRABAJO DE FRONTERA MÓVIL
El
trabajo de frontera móvil es la principal forma de trabajo relacionado con los
motores de los automóviles, durante su expansión los gases de combustión
fuerzan al embolo a moverse, el cual a su vez obliga al cigüeñal a girar.
PRIMERA LEY DE LA TERMODINÁMICA
La primera ley de la termodinámica
conocido también como el principio de la conservación de la energía establece
que la energía no se pude crear ni destruir mediante un proceso si no que solo
cambia su forma. Una consecuencia importante de la primera ley es la existencia
y definición de energía total E considerando que el trabajo es el mismo para
todos los procesos adiabáticos en un sistema cerrado entre dos estados
específicos el valor del trabajo neto debe depender únicamente de los estados
finales del sistema y por lo tanto debe corresponder al cambio en una propiedad
del sistema, esta propiedad es la energía total.
miércoles, 18 de abril de 2012
TEMPERATURA DE SATURACION Y PRESION DE SATURACION
La temperatura a la cual comienza a hervir el agua depende de la presión; en consecuencia, si la presión es constante, sucede lo mismo con la temperatura de ebullición.
A una determinada presión, la temperatura a la que una sustancia pura cambia de fase se llama temperatura de saturación. Del mismo modo a una temperatura determinada, la presión a la que una sustancia pura cambia de fase se le llama presión de saturación.
Para fundir un sólido o vaporizar un líquido se requiere una gran cantidad de energía. La cantidad de esta que es absorbida o liberada durante el proceso de cambio de fase se llama calor latente. La cantidad de energía absorbida durante la fusión se llama calor latente de fusión y equivale a la cantidad de energía liberada durante la congelación. De modo similar, la cantidad de energía absorbida durante la evaporación se llama calor latente de evaporación y es equivalente a la energía liberada durante la condensación.
VAPOR SATURADO Y VAPOR SOBRECALENTADO
Una vez que empieza la ebullición, el aumento de temperatura se detiene hasta que se evapora el líquido, es decir, si la presión se mantiene constante, durante el proceso de cambio de fase la temperatura también lo hará. Durante un proceso de ebullición, el único cambio observable es un gran aumento en el volumen y una disminución constante en el nivel de líquido como resultado de una mayor cantidad de este convertido en vapor.
En un momento el cilindro contiene cantidades iguales de líquido y vapor (mezcla saturada de líquido y vapor). Conforme continúa la transferencia de calor, el proceso de evaporización continuara hasta evaporarse la última gota de líquido (vapor saturado). En este punto el cilindro está lleno de vapor, el cual se halla en el borde de la fase liquida y cualquier cantidad de calor que pierda lo hará condensarse (cambio de fase de vapor a liquido). Un vapor que está a punto de condensarse se llama vapor saturado, y una sustancia entre los estados 2 y 4 se conoce como vapor húmedo o mezcla saturada de liquido vapor, debido a que en este estado las fases liquida y de vapor existen en equilibrio.
Una vez completado, el proceso de cambio de fase descrito anteriormente termina y se alcanza una región de una sola fase (en este caso vapor). En este punto, transferir mas calor da como resultado un aumento de temperatura y de volumen específico. Un vapor que no está a punto de condensarse (es decir, que no es vapor saturado) se denomina vapor sobrecalentado.
Si todo el proceso anterior se invierte, enfriando el agua mientras se mantiene la presión en el mismo valor, el agua regresara al estado 1 trazando de nuevo la misma trayectoria, y de esta manera la cantidad de calor liberado corresponderá a la cantidad de calor agregada mediante el proceso de calentamiento.NOTA: en la vida cotidiana agua significa agua líquida y vapor indica vapor de agua. Sin embargo, en termodinámica tanto el agua como el vapor significa solo una cosa: H2O.
LIQUIDO COMPRIMIDO Y LÍQUIDO SATURADO
Considere un dispositivo de cilindro embolo que contiene agua líquida a 20°C y 1 atm de presión. En estas condiciones el agua existe en fase liquida y se denomina liquido comprimido, lo cual significa que no está a punto de evaporarse. Se transfiere calor al agua hasta aumentar su temperatura a, por ejemplo 40°C. A medida que aumenta la temperatura, el agua líquida se expande un poco y por consiguiente aumentara su volumen especifico y debido a esta expansión el embolo sube ligeramente. La presión en el cilindro permanece constante en 1 atm durante este proceso porque depende de la presión barométrica externa y el peso del embolo que son constantes. El agua es un líquido comprado en este estado todavía puesto que no ha comenzado a evaporarse.
Conforme se transfiere más calor, la temperatura aumenta hasta alcanzar 100°C, punto en que el agua todavía permanece liquida pero cualquier adición de vapor hace que se vaporice algo de agua; es decir, está a punto de tener lugar un proceso de cambio de fase de liquido a vapor. Un líquido que está a punto de evaporarse se llama líquido saturado; así el estado 2 corresponde al de un líquido saturado.
PROCESOS DE CAMBIO DE FASE EN SUSTANCIAS PURAS
Hay muchas situaciones prácticas donde dos fases de una sustancia pura coexisten en equilibrio, por ejemplo el agua existe como una mezcla de líquido y vapor en la caldera y en el condensador de una termoeléctrica, y el refrigerante que pasa de líquido a vapor en el congelador de un refrigerador.
FASES DE UNA SUSTANCIA PURA
Las sustancias existen en diferentes fases. Aunque principalmente hay tres fases (solida, liquida y gaseosa) una sustancia puede tener varias fases dentro de la principal, cada una con distinta estructura molecular. Por ejemplo el carbono existe como grafito o como diamante en la fase solida, el helio tiene dos fases liquidas y el hierro tres fases solidas.
2 UNIDAD PROPIEDADES DE LAS SUSTANCIAS PURAS
SUSTANCIA PURA
Una sustancia que tiene una composición química fija en cualquier parte se llama sustancia pura.
Una sustancia pura no tiene que estar conformada por un solo elemento o compuesto químico. Una mezcla de varios de estos también califica como una sustancia pura siempre y cuando la mescla sea homogénea. El aire por ejemplo, es una mezcla de varios gases, pero con frecuencia se considera como una sustancia pura por que tiene una composición química uniforme, sin embargo, la mezcla de aceite y agua no es una sustancia pura, ya que el aceite no es soluble en agua por lo que se acumula en la superficie y se forman dos regiones químicamente distintas.
Una mezcla de dos o más fases de una sustancia pura se sigue considerando pura mientras la composición química de las fases sea la misma. Una mezcla de hielo y agua líquida, por ejemplo, es una sustancia pura porque ambas fases tienen la misma composición química. Una mezcla de aire líquido con otro gaseoso no compone una sustancia pura debido a que la composición del aire líquido es distinta a la del estado gaseoso, por lo tanto la mezcla ya no es químicamente homogénea.martes, 17 de abril de 2012
PRESIÓN
La presión se define como una fuerza normal que ejerce un fluido por unidad de área. Se habla de presión solo cuando se trata de gas o líquido, mientras que la contraparte de la presión (la presión en los sólidos es el esfuerzo normal). Puesto que la presión se define como la fuerza por unidad de área, tiene como unidad los newtons por metro cuadrado (N/m2), también conocida como pascal.
VARIACION DE LA PRESION CON LA PROFUNDIDAD
Si se considera que el punto 1 de la siguiente figura esta sobre la superficie libre de un liquido abierto a la atmosfera, donde la presion es la presion atmosferica, entonses la presion a la profundidad h desde la superficie libre se convierte en:
1 Pa = 1 N/m2
Otras tres unidades de presión de uso extendido, principalmente en Europa, son bar, atmosfera estándar y kilogramo fuerza por centímetro cuadrado:
1 bar = 105 Pa
1 atm = 101 325 Pa = 1.01325 bars = 14.696 psi
1 kgf/cm2 = 9.807 x 104 N/m2 = 0.9807 bar = 0.9679 atm
La presion real en una determinada posicion se llama presion absoluta, y se mide respecto al vacio absoluto (es decir, presion cero absoluta). Sin embargo, la mayor parte de los dispositivos para medir presion se calibran a cero en la atmosfera, por lo que indican la diferencia entre la presion absoluta y la atmosferica local; esta diferencia es la presion manometrica. Las presiones por debajo de la atmosferica se conocen como presiones de vacio y se miden mediante medidores de vacio que indican la diferencia de entre las presiones atmosferica y absoluta. Las presiones absoluta, manometrica y de vacio son todas positivas y se relacionan entre si mediante:
Pmanometrica = Pabs – Patm
Pvacio = Patm – Pabs
La presion es la fuerza compresiva por unidad de area y da la impresión de ser un vector. Sin embargo, la presion en cualquien punto de un fluido es la misma en todas direcciones, es decir tiene magnitud pero no direccion especifica y por lo tanto es una cantidad escalar.VARIACION DE LA PRESION CON LA PROFUNDIDAD
Es de esperar que la presion de un fluido en reposo no cambie en la direccion horizontal. Sin embargo, en la direccion vertical este no es el caso en un campo de gravedad. La presion de un fluido se incremente con la profundidad debido a que una mayor cantidad de este descansa sobre las capas mas profundas y el efecto de este “peso extra” en una capainferior se equilibra mediante un aumento de presión.
La presion de un fluido se incrementa de forma lineal con la profundidad.
Para distancias pequeñas a moderadas la variacion de la presion con el peso es insignificante para gases debido a su baja densidad. La presion en una habitacion llena de aire se puede suponer constante.
P = Patm + ρgh Pman = ρgh
Los liquidos son en escencia sustancias no compresibles, por lo tanto la variación de la densidad con la profundidad es insignificante. Este también es el caso para los gases cuando el cambio de elevación no es muy grande. La variación de densidad.
NOTA: La variación de densidad de líquidos o gases con la temperatura puede ser importante y necesitaría ser considerada cuando se desea obtener precisión alta.
Una consecuencia de la presión en un fluido que permanece constante en la dirección horizontal es que la presión aplicada a un fluido confinado incrementa en la misma cantidad la presión en todas partes. A esto se le llama ley de Pascal, en honor a Blaise Pascal, quien también sabía que la fuerza ejercida por un fluido es proporcional al área superficial. Comprendió que dos cilindros hidráulicos de áreas diferentes podían ser conectados y que el más grande se podía usar para ejercer una fuerza proporcionalmente mayor que la aplicada al menor. La máquina de Pascal ha sido el origen de muchas invenciones como los frenos y ascensores hidráulicos. La relación de fuerza de salida a fuerza de entrada se determina como:
La relación de área A2/A1 se llama ventaja mecánica ideal. Por ejemplo, con un gato hidráulico que tiene una relación de área de pistón de A2/A1 = 10, una persona puede levantar un automóvil de 1000 kg al aplicar solo una fuerza de 100kgf (=981N).
TEMPERATURA Y LEY CERO DE LA TERMODINAMICA
ESCALAS DE TEMPERATURA
ESCALA DE DOS PUNTOS:
- Punto fijo inferior (punto de hielo)
- Punto fijo superior (punto de vapor)
ESCALA TERMODINAMICA ABSOLUTA:
- Kelvin (K)
- Rankine (R)
| | Celsius (°C) | Fahrenheit (°F) |
| Punto fijo interior | 0 | 32 |
| Punto fijo superior | 100 | 212 |
T (°F) = 1.8 T (°C) + 32
T (K) = T (°C) + 273.15
T (R) = T (°F) + 459.67
T (R) = 1.8 T (K)
ΔT (K) = ΔT (°C)
ΔT (R) =ΔT (°F)
ΔT(R) = 1.8 ΔT (K)
ΔT (°F)= 1.8 ΔT (°C)
PROCESO DE FLUJO ESTACIONARIO
En ingeniería, un gran número de dispositivos operan por largos periodos bajo las mismas condiciones y se clasifican como dispositivos de flujo estacionario. Los procesos que utilizan tales dispositivos se pueden representar razonablemente bien mediante un proceso un poco idealizado, llamado proceso de flujo estacionario, que es posible definir como un proceso durante el cual un fluido fluye de forma estacionaria por un volumen de control. Es decir, las propiedades del fluido pueden cambiar de un punto a otro dentro del volumen de control, pero en algún punto fijo permanecen sin cambio durante todo el proceso. Por lo tanto, el volumen V, la masa m, y el contenido total de energía E del volumen de control permanecen constantes durante un proceso de flujo estacionario.
PROCESOS Y CICLOS
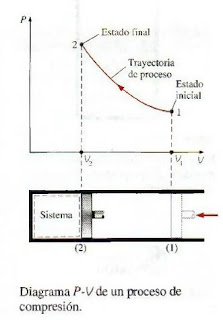
Cualquier cambio de un estado de equilibrio a otro experimentado por un sistema es un proceso, y la serie de estados por los que pasa un sistema durante este proceso es una trayectoria del proceso. Para describir completamente un proceso se deben especificar sus estados inicial y final, así como la trayectoria que sigue y las interacciones con los alrededores.
Cuando un proceso se desarrolla de tal manera que todo el tiempo el sistema permanece infinitesimalmente ceca de un estado de equilibrio, estamos ante un proceso cuasiestático, o de cuasiequilibrio. Los procesos de este tipo pueden considerarse lo suficientemente lentos como para permitirle al sistema ajustarse internamente de modo que las propiedades de una de sus partes no cambien más rápido que otras.
Cuando un proceso se desarrolla de tal manera que todo el tiempo el sistema permanece infinitesimalmente ceca de un estado de equilibrio, estamos ante un proceso cuasiestático, o de cuasiequilibrio. Los procesos de este tipo pueden considerarse lo suficientemente lentos como para permitirle al sistema ajustarse internamente de modo que las propiedades de una de sus partes no cambien más rápido que otras.
Cuando un gas en un dispositivo de cilindro embolo se comprime de forma muy rápida, las moléculas cercanas a la superficie del embolo no tendrán suficiente tiempo para escapar y se concentraran en una pequeña región frontal del embolo, de modo que ahí se creara una región de alta presión. Como resultado de esta diferencia de presión, ya no se puede decir que el sistema está en equilibrio, lo cual hace que todo el proceso no sea de cuasiequilibrio. Sin embargo, si el embolo se mueve lentamente, las moléculas tendrán tiempo suficiente para redistribuirse y no habrá concentración de moléculas al frente del embolo. Como resultado, la presión dentro del cilindro siempre será uniforme y aumentara con la misma rapidez en todos los lugares, además como el equilibrio se mantiene todo el tiempo se trata de un proceso de cuasi equilibrio.
NOTA: Un proceso de cuasiequilibrio es un caso idealizado y no corresponde a una representación autentica de un proceso real, sin embargo, muchos procesos reales se aproximan bastante y es posible modelarlos como de cuasiequilibrio.
Los diagramas de proceso trazados mediante el empleo de propiedades termodinámicas en forma de coordenadas son muy útiles para tener una representación visual del proceso.
La trayectoria del proceso indica una serie de estados de equilibrio por los que pasa el sistema durante un proceso, y que únicamente tiene importancia para procesos de cuasiequilibrio.
El prefijo iso- se usa con frecuencia para designar un proceso en el que una propiedad particular permanece constante.
PROCESO ISOTERMICO: Es aquel durante el cual la temperatura T permanece constante.
PROCESO ISOBARICO: Es en el que la presión P permanece constante
PROCESO ISOCORICO (ISOMETRICO): Es aquel donde el volumen específico v permanece constante.
Un sistema ha experimentado un ciclo si regresa a su estado inicial al final del proceso, es decir, para un ciclo los estados inicial y final son idénticos.
Suscribirse a:
Entradas (Atom)